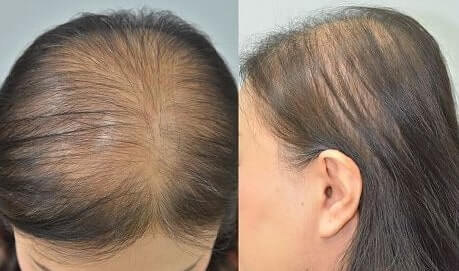
ماذا يعلمنا تساقط الشعر عن النقائل السرطانية؟

ركزت العديد من المختبرات في الدولة (الولايات المتحدة الأمريكية) جهودها على فهم كيف يمكن للخلايا السرطانية أن تنتشر – تنتقل من ورم أولي إلى أجزاء أخرى من الجسم – بالإضافة إلى تطوير علاجات للسيطرة على العملية. وجد باحثون في كلية الطب بجامعة ساوث كارولينا آلية تنظم عمليات إرسال الإشارات المتعلقة بهجرة الخلايا والورم الخبيث. في عدد 24 أكتوبر 2017 من مجلة Science Signaling ، أظهروا أن الرموش الأساسية تعمل كنقطة محورية لنقل إشارات النمو.
نعتقد أن هذه إحدى الطرق التي تهاجر بها الخلايا السرطانية من مكان إلى آخر وتحفز الورم الخبيث.
بقلم باسم أوجريتمن ، دكتوراه المؤلف الرئيسي لهذه الورقة هو مدير مشروع تطوير علاج السرطان في مركز هولينجز للسرطان وأستاذ الكيمياء الحيوية والبيولوجيا الجزيئية في جامعة ساوث كارولينا.
يبحث مختبر Ogretmen عن إشارات دهون السيراميد ، ودورها في العديد من المسارات البيولوجية ، بما في ذلك بيولوجيا السرطان. يصنع السيراميد بوظيفة عائلة مكونة من ستة أعضاء من الإنزيمات داخل الخلايا. لمعرفة كيفية عمل هذه الإنزيمات ، أنتج المختبر فئرانًا يفتقر كل منها إلى أحد إنزيمات العائلة. ومن المثير للاهتمام أن الفئران التي تفتقر إلى إنزيم Cers4 عانت من تساقط الشعر ، وهي حالة يتساقط فيها شعر الجسم كله أو جزء منه.
كيف يرتبط تساقط الشعر بالسرطان؟ اتضح أن الخلايا الكيراتينية ، أو خلايا الجلد ، تهاجر للحفاظ على بصيلات الشعر في الطبقة الخارجية من الجلد. في حالة عدم وجود إنزيم Cers4 ، تصبح الخلايا الكيراتينية غير نشطة وتهاجر بشكل طبيعي للغاية ، مما يؤدي إلى تعطيل دورة الشعر. على الرغم من أن هذا النمط الظاهري كان غير متوقع ، إلا أن الهجرة المتزايدة التي لوحظت في الخلايا الكيراتينية قد تحدث أيضًا في الخلايا السرطانية ، كما جادل Arguertman. Orgtman يقول:
قد تؤدي بعض الأنماط الظاهرية غير المتوقعة في النماذج الحيوانية إلى شيء مهم جدًا في بيولوجيا السرطان ، وهو ما يفاجئنا. في هذه الحالة ، يعلمنا تساقط الشعر حقيقة مهمة جدًا عن ورم خبيث السرطان وكيفية تنظيمه.
تظهر النتائج الأخيرة من مختبر Ogretmann أن السلالة تؤثر على هجرة الخلايا ، والتي تخضع لتنظيم صارم. عندما يتم الكشف عن السيتوكين (عامل النمو المحول بيتا) (TGF-beta) بواسطة مستقبله ، يتراكم المستقبل في أهداب الخلية الأولية ، ثم تغير الخلية بروتيناتها للسماح لها بالانتقال إلى الخلية. هو بروتين خلوي قادر على الارتباط بمستقبل TGF-beta. يمنع ارتباط السيراميد بـ Smad7 تراكم المستقبلات في أهداب الخلية ، وبالتالي يمنع السيراميد من صنع البروتينات اللازمة لهجرة الخلايا.
بعد تحديد مسار الإشارات في الخلية ، أراد الباحثون تحديد أهمية هذا المسار في مرضى السرطان. قام المختبر بمراجعة العديد من بيانات ميكروأري التي تم الإبلاغ عنها مؤخرًا من أنسجة الورم البشري (سرطان الخلايا السرطانية النقيلي في الرأس والرقبة ، وسرطان الجلد ، وسرطان الخلايا الكلوية) ووجد أن مستويات الإنزيم قد انخفضت بشكل كبير في هذه العينات. وقد وجد. بالإضافة إلى ذلك ، باستخدام الاختبارات قبل السريرية ، كانت الخلايا السرطانية التي تفتقر إلى القدرة على التعبير عن جين Cers4 أكثر عرضة للانتشار إلى الأعضاء البعيدة. يتم تقليل هذا الخطر المتزايد للورم الخبيث إلى حد ما عن طريق زيادة إنتاج smad7 ، الذي يثبط مستقبلات TGF-beta.
لسنوات عديدة ، كان يُعتقد أن التنوع الكبير في إنزيمات synthase الخلوية يشير إلى تشابه وتداخل غير ضروريين ، بمعنى آخر ، في وظيفة أعضاء عائلة الإنزيم هذه. يوضح هذا التقرير أن هذا الرأي يحتاج إلى إعادة النظر ، حيث أن السيراميد فقط من إنزيم Cers4 ينظم هجرة الخلايا بوساطة مستقبل TGF-beta.
تهدف الدراسات المستقبلية إلى تطوير نموذج أفضل لفهم نمو ورم Cers4 والورم الخبيث. تصاب سلالات معينة من الفئران بأورام الثدي الأولية التي تفتقر إلى القدرة على الانتشار. يأمل مختبر Ogretmann في فهم أفضل لكيفية تنظيم الإنزيم لهجرة الخلايا والورم الخبيث عن طريق تقليل التعبير الجيني Cers4. بالإضافة إلى ذلك ، يمكن أن تكون هذه الفئران نموذجًا ممتازًا لاختبار علاجات دوائية جديدة للوقاية من ورم خبيث.
ومع ذلك ، هناك بعض القيود على هذا النهج. يمكن أن يكون لاستهداف مستقبلات TGF-beta آثار ضارة على الأنسجة الأخرى في الجسم. بالإضافة إلى ذلك ، فإن متلازمة بارديت بيدل هي مرض استقلابي يتوقف فيه نقل البروتينات في الرموش. ونتيجة لذلك ، يمكن أن يكون استهداف تكوين الرموش مشكلة . النقطة الحاسمة هي أن علاجنا محدد قدر الإمكان في علاج النقائل. أضاف Orgtman:
لسوء الحظ ، فإن أدوية السرطان لها أهداف ، ولكن عندما تمنع هذه الأهداف في أجزاء أخرى من الجسم ، يمكن أن يكون لها تأثيرات سامة. لهذا السبب أعتقد أن البحث القائم على الآلية مهم جدًا بحيث يمكننا الحصول على مستقبلات TGF-beta بدلاً من مستقبلات الأعضاء الأخرى استهدف الرموش الأولية.